탄산 마그네슘
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탄산 마그네슘은 MgCO₃의 화학식을 갖는 무기 화합물로, 다양한 형태의 수화물과 염기성 탄산 마그네슘 형태로 존재한다. 무색 또는 백색의 고체로, 물과 에탄올에 거의 녹지 않으며 산과 반응하여 이산화탄소를 방출한다. 주로 마그네사이트 광석을 채굴하여 얻으며, 고온에서 산화 마그네슘과 이산화탄소로 분해된다. 내화 벽돌, 바닥재, 소화제, 화장품, 식품 첨가물 등 다양한 산업 분야에서 사용되며, 암벽 등반 시 미끄럼 방지용 '초크'로도 활용된다. 또한 무독성 물질로, 영국 및 일본 약전에 등재되어 있다.
더 읽어볼만한 페이지
- 등반 장비 - 밧줄
밧줄은 다양한 재료로 만들어진 섬유 끈으로, 오래전부터 건설, 항해, 등반 등 여러 분야에서 사용되었으며, 천연 섬유와 합성 섬유, 와이어 로프 등 다양한 재료와 구조로 제작되어 물체를 고정, 운반, 들어올리는 데 사용되고 현대에는 여러 분야와 문화적 의례에서도 활용된다. - 등반 장비 - 암벽화
암벽화는 등반 성능을 위해 디자인된 특수 신발로, 다양한 디자인과 종류가 있으며 발 건강 문제와 화학물질 흡입 위험이 있어 적절한 선택과 사용이 중요하다. - 제산제 - 산화 마그네슘
산화 마그네슘(MgO)은 높은 융점을 가진 고온 안정성 물질로, 내화물, 절연체, 의약품 등으로 사용되며, 다양한 제조 방법과 소성 온도에 따라 여러 형태가 존재하고, 생의학, 식품 첨가물, 환경 정화 등 다양한 분야에 활용되지만, 마그네슘 연소 시 자외선 발생 및 과다 복용 시 장폐색 등의 위험성이 있다. - 제산제 - 수산화 마그네슘
수산화 마그네슘은 마그네슘 염 수용액에 염기 수용액을 반응시켜 얻는 무색 고체로, 제산제, 설사약, 난연제 등으로 사용되며, 공업적으로는 마그네슘 염이나 해수에서 추출하고, 의학적으로는 제산제나 설사약으로, 산업적으로는 산성 폐수 중화 등에 활용된다. - 마그네슘 화합물 - 몬모릴로나이트
몬모릴로나이트는 층상구조 점토광물로 이온 교환 능력과 높은 수분 흡수력을 가지며, 토목공학, 유화 작용, 티크소트로피 등의 특징을 보이고, 알칼리성 토양 및 열수 변질 작용으로 생성되어 다양한 산업 분야와 환경 정화에 활용되며 인체 건강 및 환경 영향에 대한 연구가 진행 중이다. - 마그네슘 화합물 - 산화 마그네슘
산화 마그네슘(MgO)은 높은 융점을 가진 고온 안정성 물질로, 내화물, 절연체, 의약품 등으로 사용되며, 다양한 제조 방법과 소성 온도에 따라 여러 형태가 존재하고, 생의학, 식품 첨가물, 환경 정화 등 다양한 분야에 활용되지만, 마그네슘 연소 시 자외선 발생 및 과다 복용 시 장폐색 등의 위험성이 있다.
| 탄산 마그네슘 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
| 다른 이름 | 능고토석 Barringtonite (이수화물) Nesequehonite (삼수화물) Lansfordite (오수화물) |
| 식별 정보 | |
| 화학 물질 식별자 (ChemSpiderID) | 10563 |
| 유럽 화학 물질 데이터베이스 (ChEMBL) | 1200736 |
| 국제 화학 식별자 (InChI) | 1/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
| 국제 화학 식별자 키 (InChIKey) | ZLNQQNXFFQJAID-NUQVWONBAU |
| 화학 물질 및 생물학적 물질 데이터베이스 (ChEBI) | 31793 |
| 간소화 분자 입력 라인 표기법 (SMILES) | [Mg+2].[O-]C([O-])=O |
| 표준 국제 화학 식별자 (StdInChI) | 1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
| 표준 국제 화학 식별자 키 (StdInChIKey) | ZLNQQNXFFQJAID-UHFFFAOYSA-L |
| 화학 물질 등록 번호 (CASNo) | 546-93-0 (무수물) |
| 화학 물질 등록 번호 (CASNo) | 17968-26-2 (일수화물) |
| 화학 물질 등록 번호 (CASNo) | 5145-48-2 (이수화물) |
| 화학 물질 등록 번호 (CASNo) | 14457-83-1 (삼수화물) |
| 화학 물질 등록 번호 (CASNo) | 61042-72-6 (오수화물) |
| 고유 성분 식별자 (UNII) | 0IHC698356 |
| 고유 성분 식별자 (UNII) | 0E53J927NA (일수화물) |
| 펍켐 (PubChem) | 11029 |
| 미국 국립 직업 안전 보건 연구소 (RTECS) | OM2470000 |
| 속성 | |
| 분자량 | 84.3139 g/mol (무수물) |
| 화학식 | MgCO3 |
| 외형 | 흰색 고체, 흡습성 |
| 냄새 | 무취 |
| 밀도 | 2.958 g/cm³ (무수물) |
| 밀도 | 2.825 g/cm³ (이수화물) |
| 밀도 | 1.837 g/cm³ (삼수화물) |
| 밀도 | 1.73 g/cm³ (오수화물) |
| 용해도 | 무수물: 0.0139 g/100 mL (25 °C), 0.0063 g/100 mL (100 °C) |
| 용해도 곱 | 10−7.8 |
| 다른 용매에 대한 용해도 | 산, 수성 CO2에 용해됨, 아세톤, 암모니아에 불용해 |
| 녹는점 | 350 °C (분해, 무수물), 165 °C (삼수화물) |
| 굴절률 | 1.717 (무수물) |
| 굴절률 | 1.458 (이수화물) |
| 굴절률 | 1.412 (삼수화물) |
| 자기 감수율 | −32.4·10−6 cm³/mol |
| 구조 | |
| 결정 구조 | 삼방정계 |
| 공간군 | R3c, No. 167 |
| 열화학 | |
| 표준 생성 엔탈피 (ΔHf) | −1113 kJ/mol |
| 엔트로피 (S) | 65.7 J/mol·K |
| 표준 생성 자유 에너지 (ΔGf) | −1029.3 kJ/mol |
| 열용량 (Cp) | 75.6 J/mol·K |
| 약리학 | |
| ATC 코드 | A02AA01 |
| ATC 보충 | A06AD01 |
| 위험성 | |
| 물질안전보건자료 (SDS) | ICSC 0969 |
| 미국 화재 예방 협회 (NFPA) - 건강 | 1 |
| 미국 화재 예방 협회 (NFPA) - 가연성 | 0 |
| 미국 화재 예방 협회 (NFPA) - 반응성 | 0 |
| 인화점 | 불연성 |
| 허용 노출 기준 (PEL) | 시간 가중 평균 (TWA) 15 mg/m³ (총 분진) 시간 가중 평균 (TWA) 5 mg/m³ (호흡성 분진) |
| 관련 화합물 | |
| 다른 음이온 | 탄산수소 마그네슘 |
| 다른 양이온 | 탄산 베릴륨 탄산 칼슘 탄산 스트론튬 탄산 바륨 탄산 라듐 |
| 관련 화합물 | 아티나이트 하이드로마그네사이트 다이핑자이트 |
2. 형태
탄산 마그네슘의 가장 일반적인 형태는 마그네사이트(MgCO₃)라고 불리는 무수염과 바링토나이트(MgCO₃·2H₂O), 네스케호나이트(MgCO₃·3H₂O), 랜스포다이트(MgCO₃·5H₂O)로 알려진 2수화물, 3수화물, 5수화물이다.[1] 아르티나이트(Mg₂CO₃(OH)₂·3H₂O), 수산화마그네슘(Mg₅(CO₃)₄(OH)₂·4H₂O), 디핑가이트(Mg₅(CO₃)₄(OH)₂·5H₂O)와 같은 염기성 탄산 마그네슘도 광물로 존재한다. 이러한 광물들은 모두 무색 또는 백색을 띤다.
마그네사이트는 방해석 구조로 결정화되며, 여기서 마그네슘(Mg²⁺)은 여섯 개의 산소 원자에 둘러싸여 있다.[5] 2수화물은 삼사정계 구조를 가지며, 3수화물은 단사정계 구조를 갖는다.
| 탄산염 배위 | 마그네슘 배위 | 단위세포 |
|---|---|---|
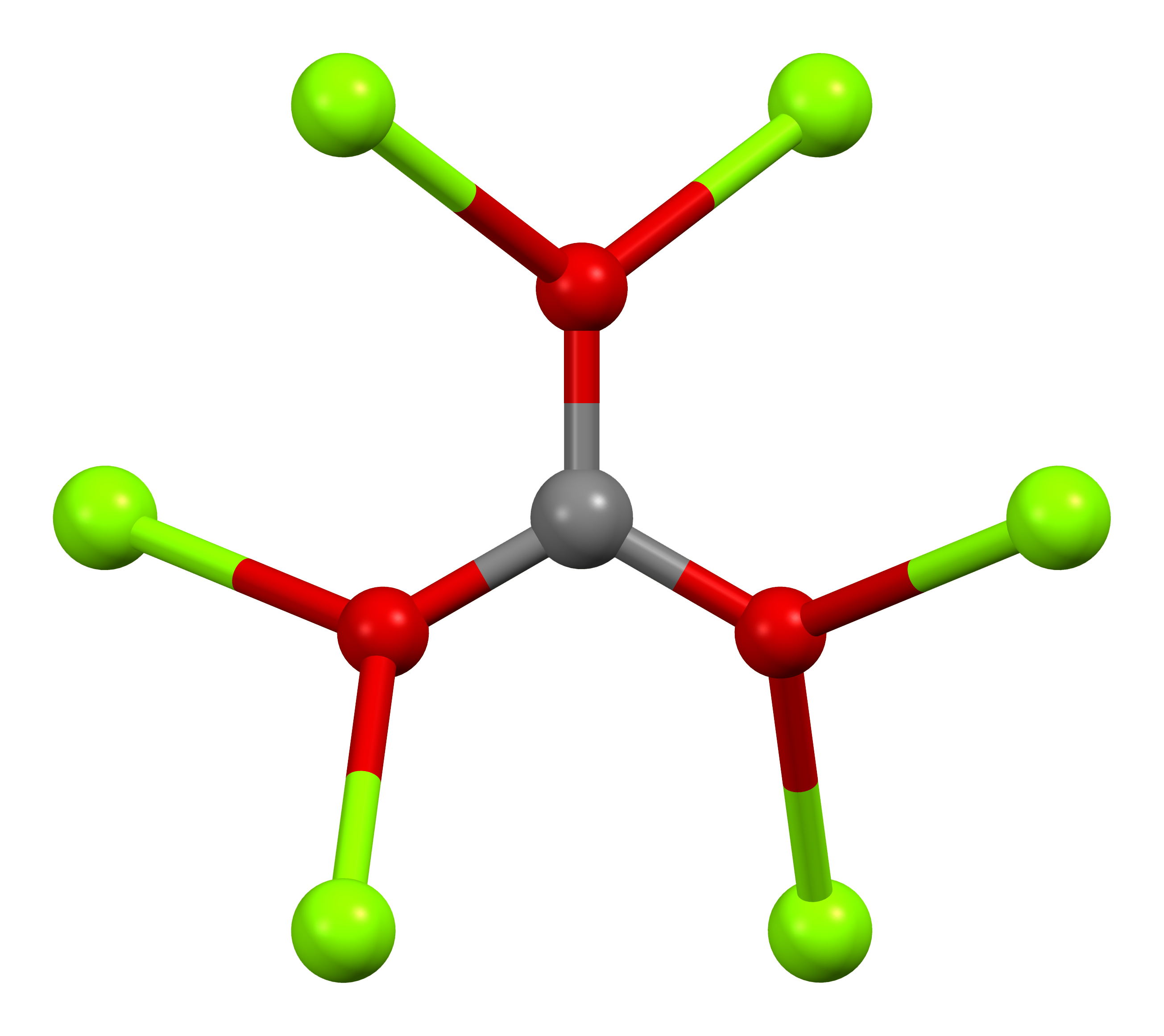 | 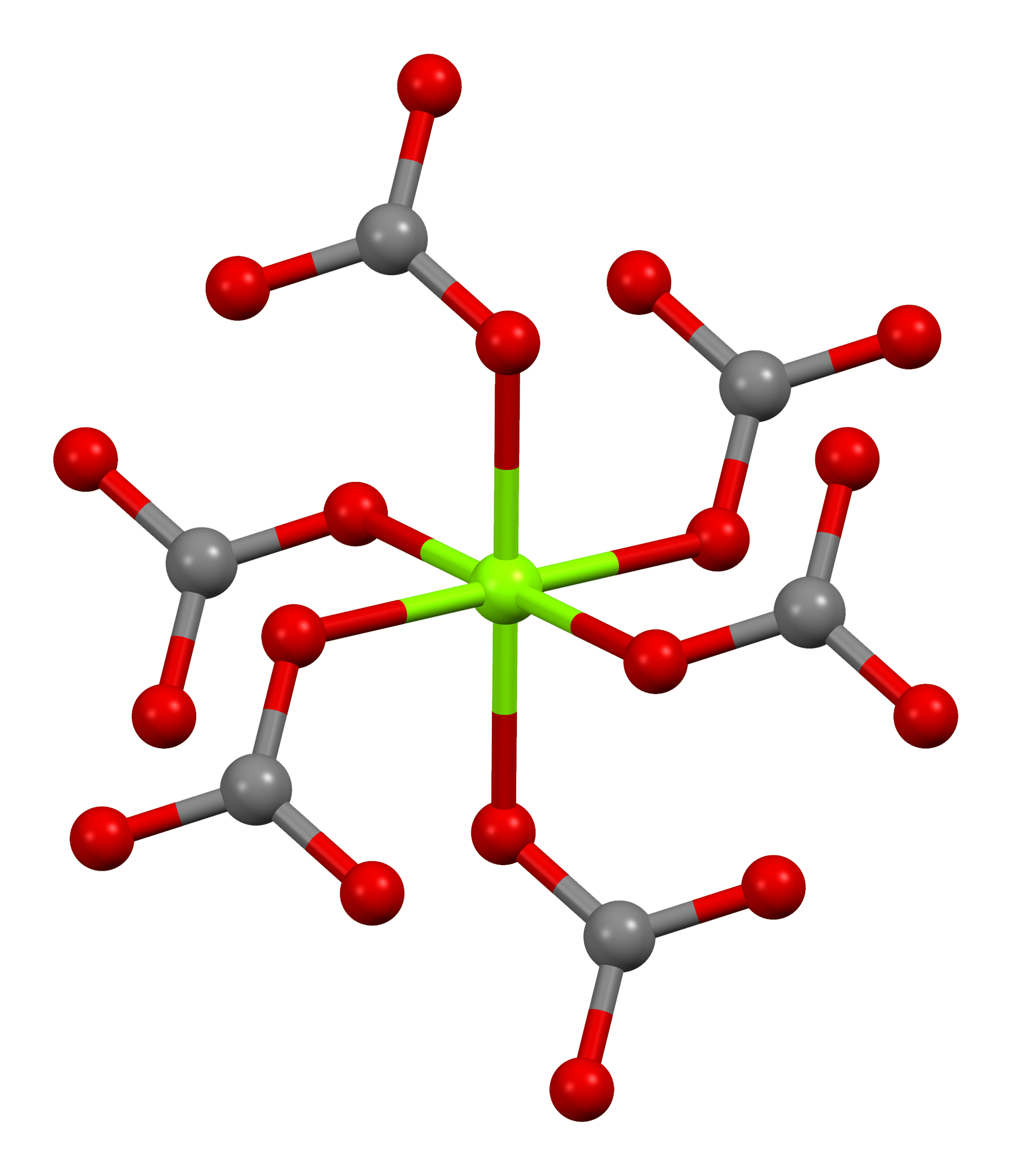 | 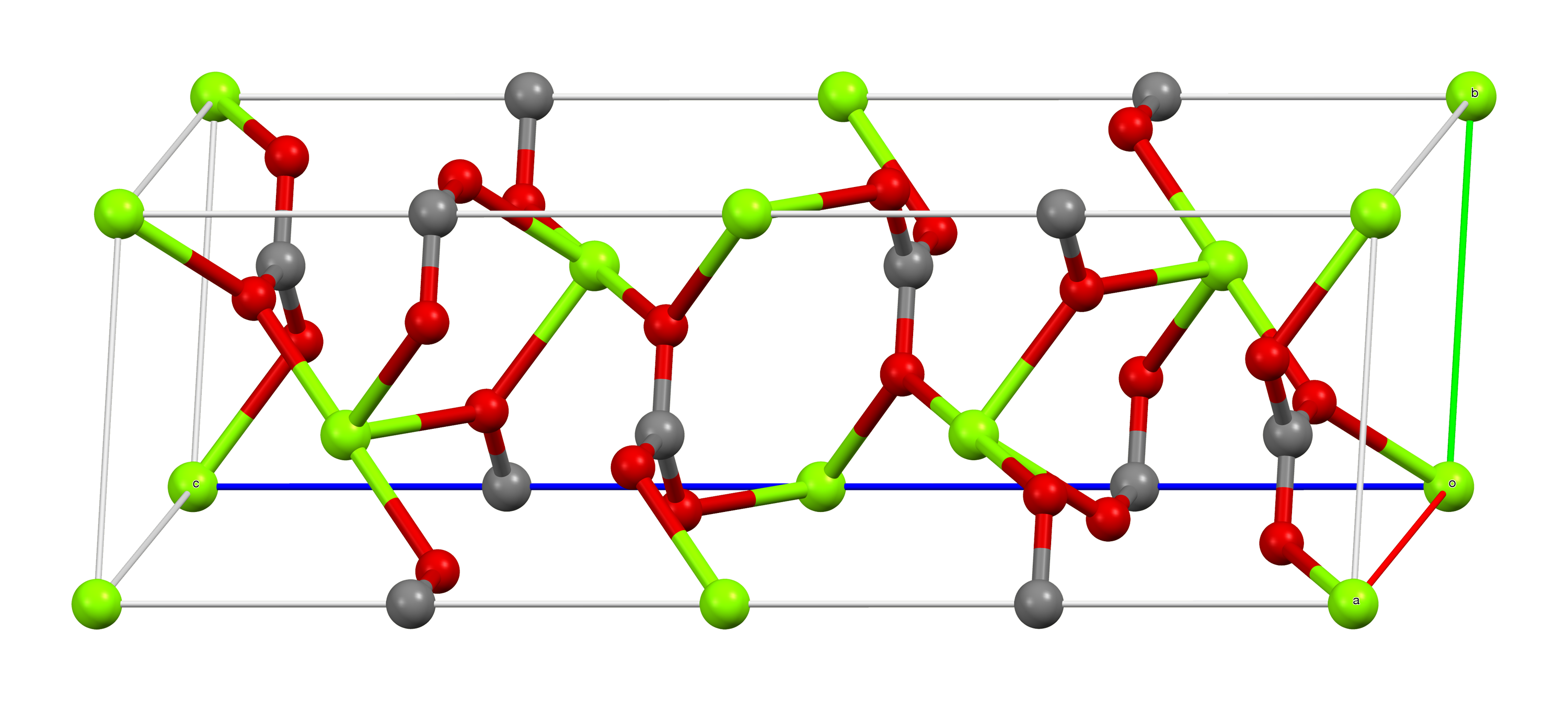 |
탄산 마그네슘은 주로 마그네사이트 광석을 채굴하여 얻는다. 전 세계 공급량의 70%는 중국에서 채굴 및 가공된다.[8]
많은 일반적인 2족 금속 탄산염과 마찬가지로, 탄산 마그네슘은 수용액 산과 반응하여 이산화탄소와 물을 방출한다.[1]
"경량" 및 "중량" 탄산 마그네슘은 실제로는 각각 수산화마그네슘 및 디핑가이트를 가리킨다.[6]
3. 생성
실험실에서는 수용성 마그네슘 염과 탄산수소나트륨의 반응을 통해 탄산 마그네슘을 제조할 수 있다.
염화 마그네슘(또는 황산마그네슘)을 탄산 나트륨 수용액으로 처리하면 탄산 마그네슘 자체가 아닌, 탄산 마그네슘과 수산화 마그네슘의 수화물 복합체인 염기성 탄산 마그네슘 침전물이 생성된다.
고순도 산업적 제조 방법으로는 탄산수소 마그네슘을 이용하는 방법이 있다. 이는 수산화 마그네슘 슬러리와 이산화 탄소를 고압과 적당한 온도에서 반응시켜 생성할 수 있다.[9] 그런 다음 탄산수소 마그네슘을 진공 건조하면 이산화 탄소와 물 분자가 제거된다.
4. 화학적 성질
:MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
:MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
고온에서 MgCO3는 산화 마그네슘과 이산화 탄소로 분해된다. 이 과정을 소성이라고 한다.[1]
:MgCO3 → MgO + CO2 (ΔH = +118 kJ/mol)
분해 온도는 350°C로 알려져 있다.[10][11] 그러나, 발생한 이산화 탄소의 재흡착 때문에 900°C 이하에서는 산화물로의 소성이 일반적으로 완료되지 않은 것으로 간주된다.
염의 수화물은 분해 중 서로 다른 온도에서 물을 잃는다.[12] 예를 들어, 삼수화물 MgCO3·3H2O (분자식은 Mg(HCO3)(OH)·2H2O로 쓸 수 있다)의 경우, 탈수 단계는 157°C와 179°C에서 일어난다.[12]
:Mg(HCO3)(OH)·2(H2O) → Mg(HCO3)(OH)·(H2O) + H2O (157°C)
:Mg(HCO3)(OH)·(H2O) → Mg(HCO3)(OH) + H2O (179°C)
: MgCO3 -> MgO + CO2
5. 용도
탄산 마그네슘은 주로 소성을 통해 산화 마그네슘을 생산하는 데 사용된다. 마그네사이트와 돌로마이트 광물은 내화벽돌 생산에 사용된다.[1] 또한 바닥재, 내화재, 소화제, 화장품, 분산제, 치약 등에도 사용된다. 충전재, 플라스틱의 발연 억제제, 네오프렌 고무의 강화제, 건조제, 식품의 색상 유지제로도 사용된다.
1911년에는 물에 대한 용해도가 낮고 흡습성이 있는 탄산 마그네슘을 식탁용 소금에 첨가하여 유동성을 향상시켰다. 모튼 솔트 회사는 탄산 마그네슘을 함유한 소금이 습한 날씨에도 뭉치지 않는다는 점을 강조하며 "When it rains it pours"라는 슬로건을 채택했다.[13]
'클라이밍 초크' 또는 '짐 초크'로 알려진 분말 탄산 마그네슘은 암벽 등반, 체조, 파워리프팅, 역도 등 단단한 그립이 필요한 스포츠에서 운동선수의 손을 건조하게 유지하는 건조제로 사용된다.[8] 액체 초크도 있다.
식품 첨가물로서 탄산 마그네슘은 E504로 알려져 있으며, 고농도에서는 완하제로 작용할 수 있다.[14]
박제 시 두개골을 하얗게 만드는 데 사용된다. 과산화 수소와 섞어 페이스트를 만들어 두개골에 바르면 흰색으로 마감할 수 있다.
영사막에 무광택 흰색 코팅으로 사용된다.[15]
고순도 탄산 마그네슘은 제산제로 사용되며, 소금에 첨가하여 흡습성을 방지한다. 탄산 마그네슘은 물에는 녹지 않고 산에만 녹아 거품(발포)을 발생시키기 때문에 이러한 용도로 사용될 수 있다.[16]
산업용 원료로서는 내화·단열 재료, 비료 원료, 잉크·도료 첨가제, 유리 첨가제, 제지, 화장품 첨가제, 식품 첨가제 등으로 사용된다. 또한 제산제, 완하제(의약품), 치약의 연마제, pH 알칼리화용 보충제, 각종 운동 용구의 미끄럼 방지제("탄마", "탄마그"로 약칭) 및 클라이밍 초크로도 사용된다.
6. 안전성
탄산 마그네슘은 무독성이며 불연성 물질이다.
7. 약전 등재
참조
[1]
저널
Experimental determination of the solubility product of magnesite at 50 to 200 °C
[2]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[3]
웹사이트
Magnesium carbonate
http://chemister.ru/[...]
[4]
PGCH
[5]
저널
The equation of state and high-pressure behavior of magnesite
[6]
저널
Preparation of a magnesium hydroxy carbonate from magnesium hydroxide
[7]
서적
General and inorganic chemistry, 2nd ed.
[8]
웹사이트
The Hidden Environmental Cost of Climbing Chalk
https://www.climbing[...]
Cruz Bay Publishing
2018-05-21
[9]
Ullmann
Magnesium Compounds
[10]
웹사이트
IAState MSDS
http://avogadro.chem[...]
[11]
서적
CRC Handbook of Chemistry and Physics
https://archive.org/[...]
CRC Press
[12]
웹사이트
Conventional and Controlled Rate Thermal analysis of nesquehonite Mg(HCO3)(OH)·2(H2O)
http://core.kmi.open[...]
[13]
웹사이트
Her Debut - Morton Salt
http://www.mortonsal[...]
2017-12-27
[14]
웹사이트
Food-Info.net : E-numbers : E504: Magnesium carbonates
http://www.food-info[...]
[15]
서적
Certified Technology Specialist-Installation
McGraw Hill Education
[16]
웹사이트
What Is Magnesium Carbonate?
https://sciencing.co[...]
2017-04-24
[17]
웹사이트
Index, BP 2009
http://www.pharmacop[...]
2010-01-31
[18]
웹사이트
Japanese Pharmacopoeia, Fifteenth Edition
http://jpdb.nihs.go.[...]
2010-01-31
[19]
저널
Experimental determination of the solubility product of magnesite at 50 to 200 °C
[20]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[21]
웹인용
Magnesium carbonate
http://chemister.ru/[...]
[22]
PGCH
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
